卵巢功能抑制有效提高绝经前乳腺癌患者内分泌治疗应答率|SABCS 2023
第 46 届圣安东尼奥乳腺癌研讨会(SABCS)于 12 月 5-9 日在美国圣安东尼奥召开,作为全球乳腺癌领域最为重要的国际学术会议之一,本届 SABCS 大会将继续聚焦乳腺癌和癌前乳腺疾病的实验生物学,病因学,预防,诊断和治疗最新进展,提供学术交流互动和继续教育平台。
在本届 SABCS 大会上,西德研究协作组(WSG)Oleg Gluz 教授分享了题为 「Impact of age and ovarian function suppression (OFS) on endocrine response to short preoperative endocrine therapy (ET): Results from the multicenter ADAPTcycle trial (n = 4,334)」 的报告,详细介绍了 ADAPTcycle 试验结果。

图 1:大会学术汇报
研究背景
对于 HR+/HER2-早期乳腺癌(EBC),术前短期内分泌治疗(ET)是一种很有前景的治疗方式,其疗效可根据 ET 2-4 周后 Ki67 的下降情况来评估。
大型前瞻性试验结果表明,内分泌治疗后的低 Ki67(Ki67post)与良好的预后有关。WSG-ADAPT 试验证明,ET 应答是辅助化疗适应症不确定情况下的有效决策标准,如 N0 期且复发评分(RS)16-25 分或 N1 期且 RS≤25 分的绝经前患者。如果 RS≤25,且经过术前短期 ET 后出现 ET 应答(Ki67post ≤ 10%),则 N0-1 期患者单独辅助 ET 的 5 年疗效极佳(≤50 岁患者的 5 年无远处疾病生存率 [dDFS] 为 97%)。
ADAPTcycle III 期试验的初步结果表明,如果卵巢功能抑制(OFS)与他莫昔芬(TAM)或芳香化酶抑制剂(AI)联合应用于绝经前患者,其术前 ET 的疗效更高。在最终筛查人群中,将进一步就年龄亚组、RS、单个生物标记物和 OFS 对 ET 应答的影响进行研究。
研究设计及方法
ADAPTcycle 研究共 5293 例患者纳入筛选,其中,1684 例患者参与随机分配。被随机分配的患者包括 N0-1 期且 RS>25 或 N2-3 期且 RS≤25,且均为 ET 应答患者,这些患者被随机分为两组:一组接受新辅助或辅助化疗序贯标准内分泌治疗,另一组接受 ribociclib+AI(绝经前联合促性腺激素释放激素激动剂 [GnRHa])治疗。
此外,对于绝经前患者,无论 ET 应答如何,N1 期且 RS≤25 或 N0 期且 RS 16-25 者均可参与,但建议仅对 ET 应答者进行随机化。在术前阶段,建议采用 OFS+TAM 或 AI 方案进行 ET 应答评估。
本次报告主要分析术前短期内分泌治疗的内分泌应答情况及相关影响因素。
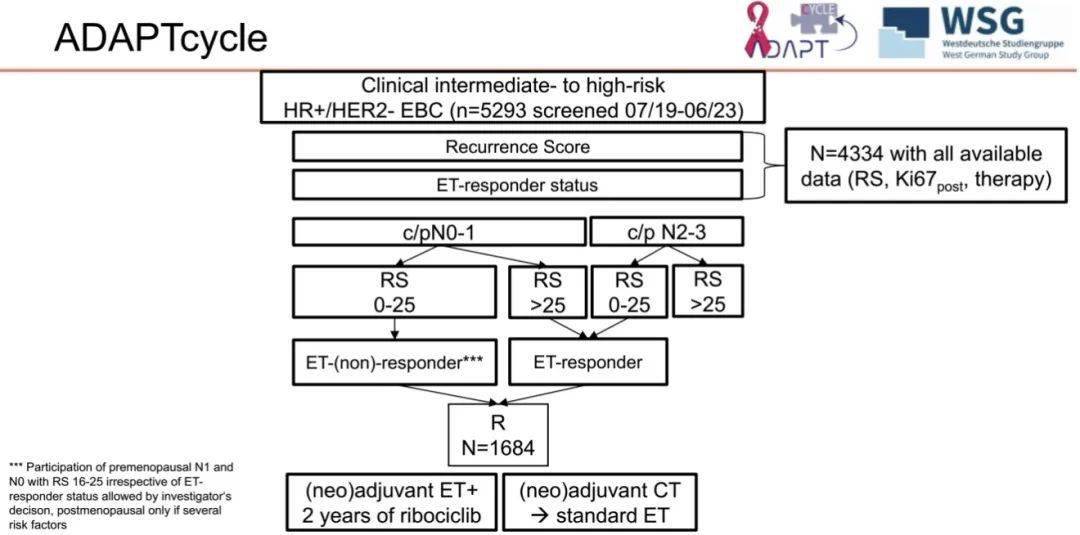
图 2:ADAPTcycle 研究设计
研究结果
最终,4334 例具有完整基线特征(包括 RS)和 ET 应答数据的患者纳入分析。ET 应答的定义是内分泌治疗 2-4 周(如果是 OFS 则为 4 周)后 Ki67post≤10%(由中心实验室进行病理评估)。ER、PR 和 HER2 水平通过 IHC 和 mRNA 进行分析。这些患者中位年龄为 56 岁(22-87 岁),中位 RS 为 20,中位基线 Ki67 为 25%。其中,54.6% 的患者分期为 cT2-4 期,28% 的患者分期为 cN+期,42.1% 的患者分级为 G3(由中心实验室进行评估)。
在 1368 例年龄 ≤50 岁且绝经前(「≤50 岁 」 组)的患者中,314 例(22.9%)接受了 AI+OFS 治疗,255 例(18.6%)接受了 TAM+OFS 治疗。在 2966 例年龄>50 岁或绝经后(「>50 岁 」 组)的患者中,2565 例(86.5%)接受了 AI 治疗。
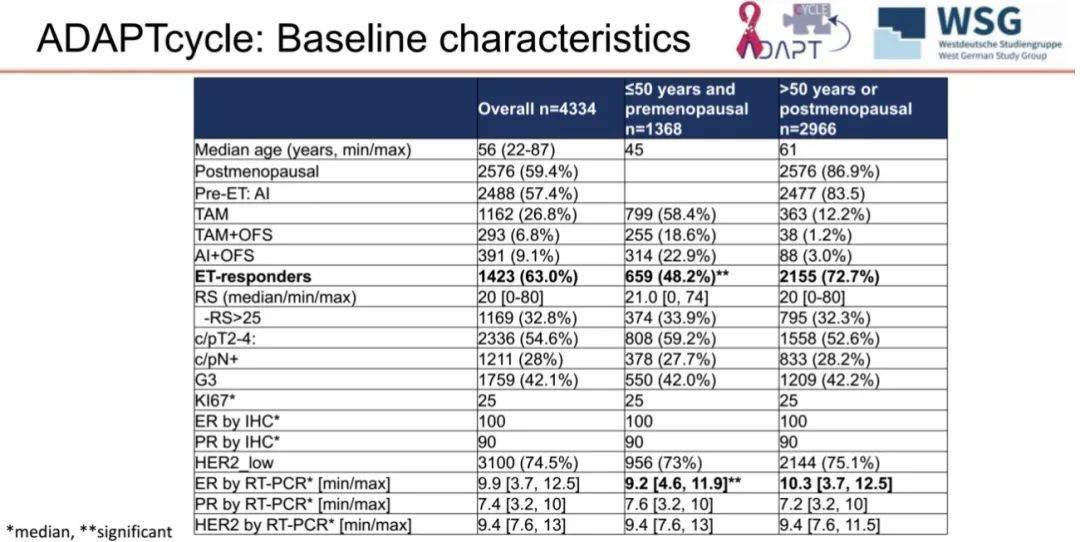
图 3:纳入分析患者基线特征
在 ET 应答率方面,「>50 岁 」 组患者的 ET 应答率(72.7%)更高,而 「≤50 岁 」 组患者的 ET 应答率为 48.2%,两组患者存在显著的统计学差异(p<0.001)。
进一步分析显示,在 「≤50 岁 」 与 「>50 岁 」 患者中,仅使用 TAM 的 ET 应答率存在明显差异(34.7% vs. 43.8%);在 「≤50 岁 」 患者中,使用 TAM+OFS 的 ET 应答率为 55.7%,而使用 AI+OFS 的 ET 应答率为 76.4%,与使用 AI 的 「>50 岁 」 患者的 ET 应答率相当(76.4%)。
此外,即使在一小部分年龄大于 50 岁且绝经前的患者(78 例)中,OFS 联合治疗的 ET 应答率也更高。
值得注意的是,即使在 RS>25 的患者中,使用 AI 的患者也能观察到很高的 ET 应答率:66.7%(「≤50 岁 」,AI+OFS)、55.6%(「>50 岁 」,AI);而单独使用 TAM 的应答率较低(>50 岁:18.2%;<50 岁:15.8%)。
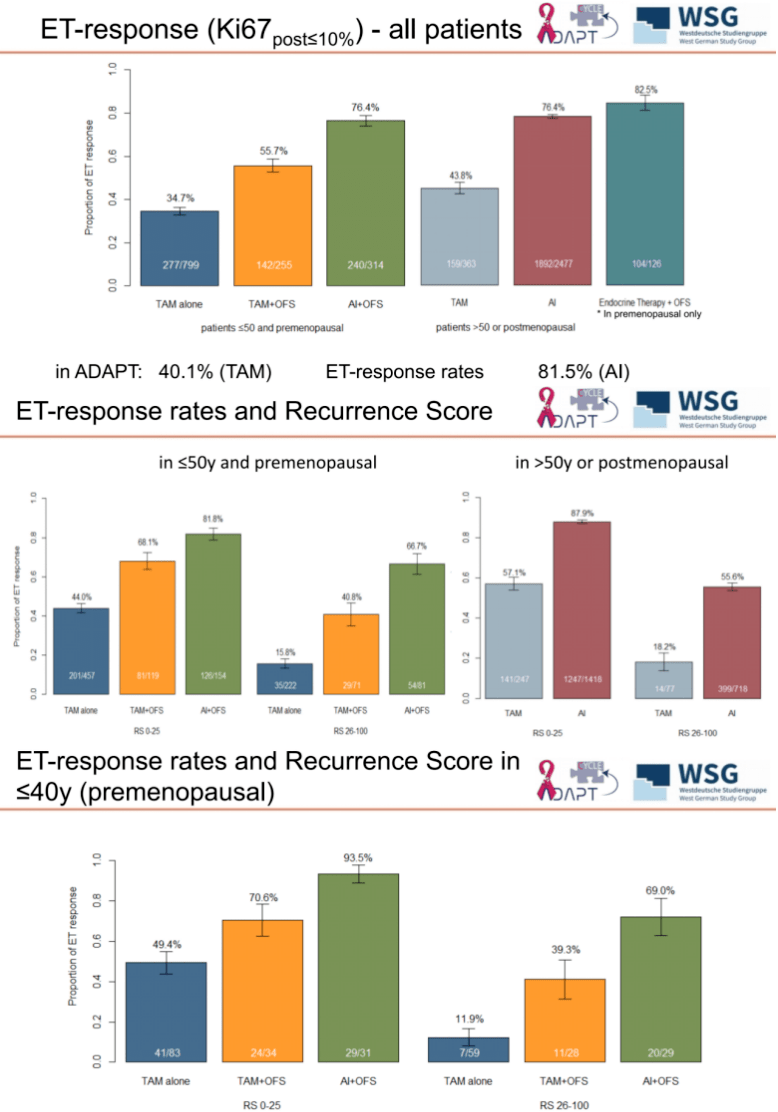
图 4:ET 应答率的亚组分析
在单因素和多因素分析中,「≤50 岁 」 患者的 ET 应答率与 ET 类型(AI 或 TAM,AI+OFS 或 TAM+OFS)、RS 和基线 Ki67 水平有关,但与年龄亚组(≤40 岁与 41-50 岁)无关。单变量分析显示,免疫组化(IHC)或逆转录聚合酶链式反应(RT-PCR)检测的 ER、PR 和 HER2 表达与 ET 应答相关。
在 「>50 岁 」 患者中,通过单变量和多变量分析,再次证实 ET 类型、RS 和基线 Ki67 以及 ER 表达(通过 IHC 检测)和 ESR1、PR 和 HER2 表达(通过 RT-PCR 检测)同样与较高的 ET 应答率相关。
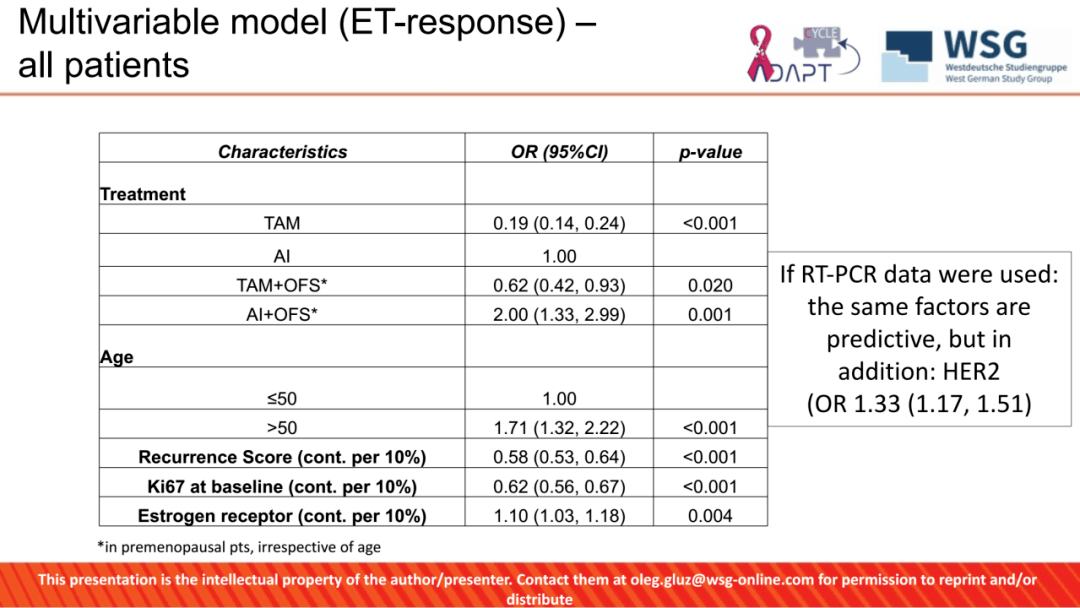
图 4:ET 应答率相关因素多因素分析结果
研究结论
ADAPT 研究和 ADAPTcycle 研究囊括了约 10000 例绝经前或绝经后患者,是国际上最大的 ET 应答情况数据库。ADAPTcycle 研究证实了接受 TAM 或 AI 治疗患者的 ET 应答率,并首次展示了在绝经前患者中使用 ET 方案后的 Ki67post 的前瞻性数据。研究还表明,无论 RS 如何,在 TAM 或 AI 中添加 OFS 能够显著提高绝经前患者 ET 应答率,这与接受 AI 治疗的绝经后患者相当。
ET 应答的评估在治疗决策中起重要作用,尤其是对于年龄 ≤50 岁的 N0-1 期患者。即使是 RS 评分较高患者,ET 应答也能提供关键信息。基于 ADAPT 和 ADAPTcycle 的结果,用于评估 ET 应答的最佳 ET 方案(类型/持续时间)为:绝经后患者使用 2-4 周 AI 治疗;绝经前患者使用 4 周 GnRH 和 AI(同时开始)。对于 HR+/HER2- N0-1 期早期乳腺癌患者,在决定是否使用化疗时,除了考虑基因表达检测外,还应评估 ET 应答情况,以最大限度地减少化疗的患者数量。
参考文献:
[1] Oleg Gluz, et al. Impact of age and ovarian function suppression (OFS) on endocrine response to short preoperative endocrine therapy (ET): Results from the multicenter ADAPTcycle trial (n = 4,334).2023 SABCS, abstract LBO1-05.
[2] Oleg Gluz 教授 2023 SABCS 学术汇报 PPT.
本文首发于丁香园旗下专业平台:丁香园肿瘤时间
作者:贝塔_内啡肽;编辑:lsh
题图来源:站酷海洛 PLUS
投稿合作:luoshuhan@dxy.cn
上一篇:尿尿分叉,我是不是生病了?
下一篇:多吃黑木耳能降血压降血脂吗?
