一文盘点:FDA 新批转移性乳腺癌药物 | SABCS 2023
第 46 届圣安东尼奥乳腺癌研讨会(SABCS)于 12 月 5-9 日在美国圣安东尼奥召开,作为全球乳腺癌领域最为重要的国际学术会议之一,本届 SABCS 大会将继续聚焦乳腺癌和癌前乳腺疾病的实验生物学,病因学,预防,诊断和治疗最新进展,提供学术交流互动和继续教育平台。
目前会议报告内容摘要多数已公布,本次大会美国食品药品监督管理局肿瘤疾病办公室(FDA Office of Oncologic Diseases)对FDA 新批转移性乳腺癌药物进行了汇报和点评,「丁香园肿瘤时间」特将相关内容汇总整理如下。
HER-2 ADC-T-DXd(德曲妥珠单抗)
说起现在最火的 ADC 无疑是 T-DXd(德曲妥珠单抗),FDA 已批准其用于 HER-2 阳性晚期乳腺癌、肺癌、胃癌的治疗。本次会议 FDA 对其在 HER-2 低表达转移性乳腺癌中获批进行了报告。
该药物获批主要是基于 DESTINY-Breast04 研究成果,DESTINY-Breast04 是一项 III 期、随机、开放标签、多中心、全球试验,研究对象为不可切除或转移性 HER2 低表达乳腺癌的成年患者,其定义为 IHC 评分为 1+ 或 2+ 且 ISH 未发现 HER2 基因扩增的肿瘤。患者必须在转移性环境中接受化疗,或在完成 (新) 辅助化疗期间或 6 个月内出现疾病复发,并以 2:1 的比例随机分配至接受 T-DXd 组(5.4 mg/kg,每 3 周静脉注射一次)或医生选择的卡培他滨、艾立布林、吉西他滨、紫杉醇或白蛋白结合紫杉醇 (TPC) 组。主要疗效终点是 HR+ 患者经盲态独立中心(BICR)评估的 PFS,关键的次要疗效终点是所有随机分配患者的 BICR 评估的 PFS, HR+ 队列的总生存期 (OS) 和所有随机分配患者的 OS。
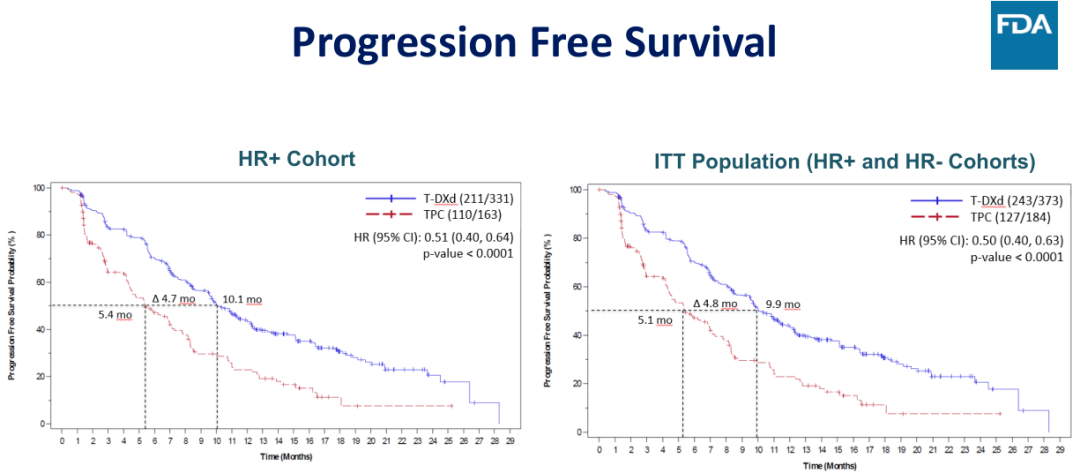
图 5:DESTINY-Breast04研究的 PFS 结果
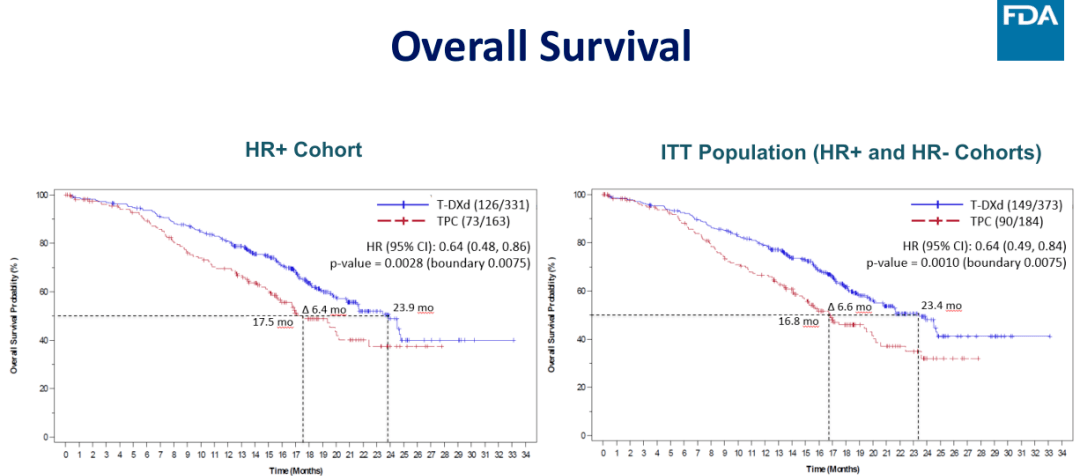
图 6:DESTINY-Breast04研究的 PFS 结果
研究结果显示,在 HR+ 队列和在意向性治疗(ITT)人群,BICR 评估的 PFS 获得了阳性结果,HR+ 队列的 mPFS 分别为 10.1 vs. 5.4 个月(HR = 0.51,95%CI:0.40-0.64,P<0.0001),意向性治疗(ITT)人群 mPFS 分别为 9.9 vs. 5.1 个月(HR = 0.50,95%CI:0.40-0.63,P<0.0001)。在次要终点 OS 方面,T-DXd 组同样取得统计学上显著和临床意义的改善,HR+队列的 mOS 分别为 23.9 vs. 17.5 个月(HR = 0.64,95%CI:0.48-0.86,P = 0.0028),意向性治疗(ITT)人群 mOS 分别为 23.4 vs. 16.8 个月(HR = 0.64,95%CI:0.49-0.84,P = 0.001)。另外,小样本入组的 HER-2 低表达的 TNBC 亚组分析结果同样显示出 T-DXd 在 PFS 和 OS 的强大获益,mPFS 为 8.5 vs. 2.9 个月(HR = 0.46),mOS 分别为 18.2 vs. 8.3 个月(HR = 0.48)。
在最终决策中,FDA 综合考虑 DESTINY-Breast04 研究结果达到主要研究终点(HR+ PFS);关键次要终点上 ITT 人群 PFS、HR 人群 OS、ITT 人群 OS 均达到终点;安全性方面没有新的安全事件发生;研究对 TNBC 亚组和(新)辅助 6 个月进展亚组获益和风险进行了评估。因而,最终 FDA 批准了 T-DXd(德曲妥珠单抗)用于既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的,不可切除或转移性 HER2 低表达(IHC 1+或 IHC 2+/ISH-)成人乳腺癌患者。
口服 ER 降解剂-Elacestrant
2023 年 1 月 27 日美国 FDA 批准了口服选择性雌激素受体降解剂(SERD)Elacestrant 用于用于既往接受过至少一线内分泌治疗后疾病进展的 ER+/HER2-、ESR1 突变的绝经后女性或成年男性晚期或转移性乳腺癌患者。Elacestrant 是一种雌激素受体拮抗剂,可与雌激素受体 α 结合,通过蛋白酶体途径诱导雌激素受体 α 蛋白降解,抑制 17β-雌二醇介导的细胞增殖。
该药物获批主要是基于 EMERALD 研究成果,研究纳入既往接受过 1 或 2 次内分泌治疗的乳腺癌患者,所有患者均接受过 CDK4/6 抑制剂治疗,但接受过 ≤1 次化疗。入组患者随机分配至 Elacestrant(n = 239)和标准内分泌治疗组(SOC,n = 238,包括氟维司群,阿那曲唑,来曲唑或依西美坦)。研究的主要终点是总人群和 ESR1 突变患者中 BICR 评估的 PFS,次要研究终点是 OS。
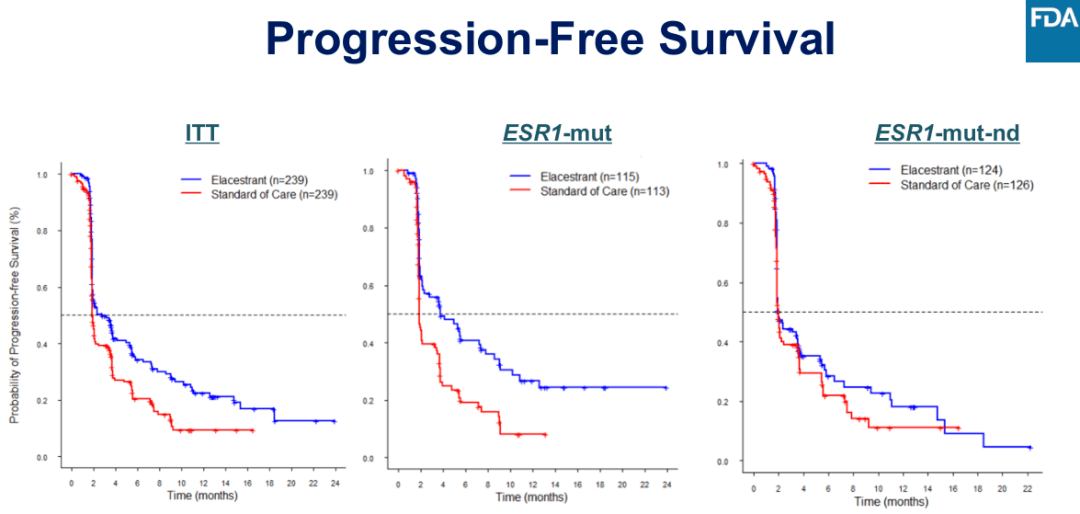
图 1:EMERALD 研究的 PFS 结果
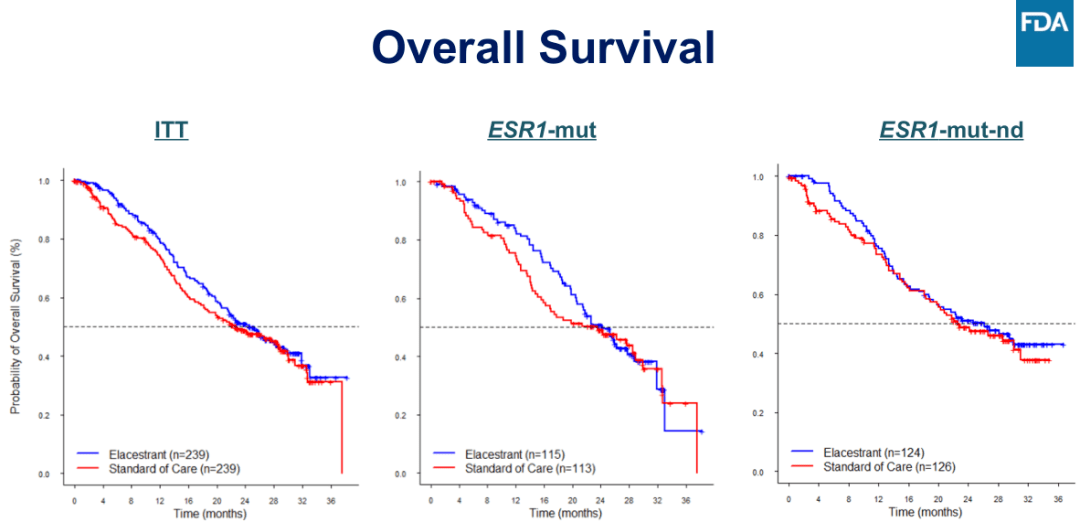
图 2:EMERALD 研究的 OS 结果
研究结果显示,在意向性治疗(ITT)人群和携带 ESR1 突变的患者亚组中,观察到 PFS 有统计学意义的差异,总人群 mPFS 2.8 vs. 1.9 个月(HR = 0.70,95%CI:0.55-0.88,P = 0.002),ESR1 突变的患者 mPFS 3.8 vs. 1.9 个月(HR = 0.55,95%CI:0.39-0.77,P<0.001)。在次要终点 OS 方面,总人群 mOS 24.6 vs. 22.6 个月(HR = 0.91,95%CI:0.71-1.18,P = 0.002),ESR1 突变的患者 mOS 24.2vs. 23.5 个月(HR = 0.90,95%CI:0.63-1.30)。安全性方面 Elacestrant 与其他内分泌治疗方法一致,大多数不良事件都是轻中度(1 级和 2 级),其胃肠道反应和血脂异常不良反应发生率有所升高。
虽然 Elacestrant 在意向性治疗(ITT)人群和携带 ESR1 突变的患者亚组的主要终点 PFS 均取得差异具有统计学意义的获益,但 ESR1 阴性的患者亚组的 PFS 未取得差异具有统计学意义的获益,FDA 认为 Elacestrant 意向性治疗(ITT)人群获益来自 ESR1 突变的患者亚组,因而Elacestrant 仅获批用于 ESR1 突变的患者。
Elacestrant 为 FDA 批准的首个口服 SERD,在此之前,氟维司群是唯一获批上市的 SERD 药物,但是较差的药代动力学性质也导致氟维司群只能肌肉注射。Elacestrant 的成功上市也极大程度上为口服 SERD 的探索之路树立了信心。
AKT 通路抑制剂-Capivasertib
2023 年 11 月 17 日美国 FDA 批准了 AKT 通路抑制剂-Capivasertib 上市,该药获批适应症为 Capivasertib 联合氟维司群用于治疗 HR 阳性/HER2 阴性且携带至少一种 PIK3CA/AKT1/PTEN 突变的局部晚期或转移性乳腺癌患者,患者需在至少接受过一种以芳香化酶抑制剂为基础的治疗后或在完成辅助治疗后的 12 个月内复发。PI3K-AKT 通路是细胞内重要的信号传导通路之一,AKT 在细胞凋亡、血管生成、肿瘤转移过程中发挥重要作用,Capivasertib 是一种抑制丝氨酸/苏氨酸激酶 AKT 的抑制剂,也是全球首个获得批准的该类药物。
该药物获批主要是基于 CAPItello-291 研究成果,CAPItello-291 是一项全球多中心、双盲、随机的Ⅲ期临床试验,旨在评估 Capivasertib 联合氟维司群对比安慰剂联合氟维司群治疗不可手术局部晚期或转移性 HR+/HER2 低表达或阴性乳腺癌的安全性和有效性。研究入组了了 708 例经组织学证实为 HR+、HER2 低表达或阴性乳腺癌的患者,这些患者在接受芳香化酶抑制剂(AI)治疗期间或治疗后疾病复发或进展,使用过或没有使用过 CDK4/6 抑制剂,患者针对晚期疾病至多进行一线化疗。研究的主要终点为总体人群和携带 PIK3CA/AKT1/PTEN 基因突变患者亚组的无进展生存期(PFS),次要终点为总体人群和携带 PIK3CA/AKT1/PTEN 基因突变患者亚组的总生存期(OS)及 ORR、DoR。在研究中,实验组有 40% 的患者确定存在 PI3K/AKT/PTEN 突变,对照组中 48% 的患者确定存在 PI3K/AKT/PTEN 突变。
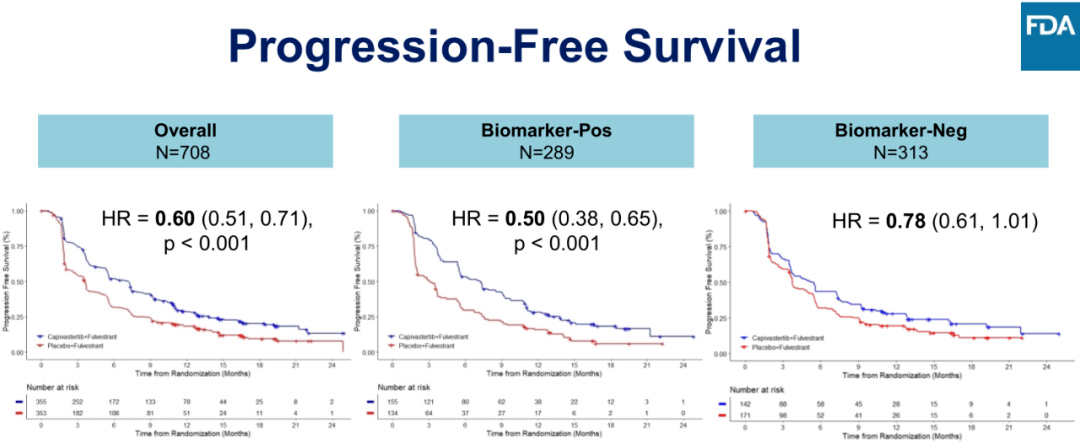
图3:CAPItello-291 研究的 PFS 结果
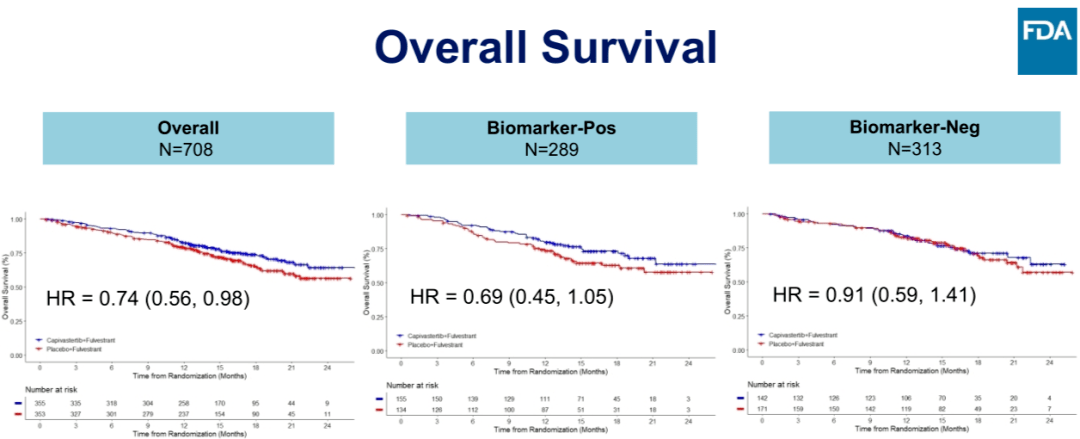
图4:CAPItello-291 研究的 OS 结果
研究结果显示,与安慰剂联合氟维司群相比,Capivasertib 联合氟维司群的无进展生存期(PFS)具有统计学意义和临床意义的改善,在主要人群中,Capivasertib+氟维司群和氟维司群组 mPFS 分别为 7.2 vs. 3.6 个月(HR = 0.60,95%CI:0.51-0.71,P<0.001),在 PI3K/AKT/PTEN 基因突变亚组中,mPFS 分别为 7.3 vs. 3.1 个月(HR = 0.50,95%CI:0.38-0.65,P<0.001)。在次要终点方面,在主要人群中,ORR 为 22.9% vs 12.2%;在 PI3K/AKT/PTEN 信号通路人群中,ORR 为 28.8% vs 9.7%;OS 数据不成熟,将继续评估。在安全性方面,Capivasertib 联合氟维司群在高血糖、腹泻、皮疹不良反应发生率高于安慰剂联合组。
虽然 CAPItello-291 研究在主要人群和携带 PIK3CA/AKT1/PTEN 基因突变的患者亚组的主要终点 PFS 均取得具有统计学意义的明显获益,但 FDA 认为 PIK3CA/AKT1/PTEN 基因突变阴性亚组的 PFS 和 OS 结果获益程度完败于 PIK3CA/AKT1/PTEN 基因突变阳性组。且相较 Capivasertib 联合治疗导致的安全事件(AE)上升,其获益并不显著,因此 FDA 仅批准 Capivasertib 联合治疗用于至少存在一种 PIK3CA/AKT1/PTEN 突变的患者。
本文首发于丁香园旗下专业平台:丁香园肿瘤时间
作者:毛阳;编辑:lsh;
题图:丁香园创意团队
投稿:luoshuhan@dxy.cn

